林先茂,蔡亲武,杨子江
(万宁市人民医院 儿科,海南 万宁 571500)
肺炎支原体(MP)是一种可附着在呼吸道黏膜纤毛上皮细胞上的细胞外病原体,通过激活多种信号通路,造成肺组织损伤[1]。目前对于MP肺炎(MPP)患儿,多采用大环内酯类抗生素进行适当治疗,但仍有部分患儿会长期发热并伴有放射学表现恶化[2]。对于这部分难治性患儿,额外的皮质类固醇可以有效改善临床症状和胸部影像学表现[3]。对皮质类固醇的快速反应表明,机体免疫状态与疾病的严重程度和活动性有关,例如Th17/Treg细胞失衡[4]。以往的研究表明,微小RNA(miRNA)能够调节基因表达的转录或转录后状态,并在免疫反应引起的过度炎症中发挥作用[5-6]。例如Li等[5]证实miR-29c/B7-H3/Th17轴通过引起过度炎症在MP感染中发挥着重要作用,但是miR-29c与MPP患儿Th17/Treg细胞失衡的关系尚不明确,故本研究旨在通过研究MPP患儿外周血miR-29c表达与Th17和Treg细胞分化情况及其细胞因子水平的关系,为临床治疗MPP提供新的方向。
1.1 对象 本项研究在获得当地医学伦理委员会批准后,于2019年8月至2021年4月在我院儿科共纳入108例MPP患儿,包括58例大环内酯类抗菌药物敏感的MPP患儿(MSMP组)和50例难治性MPP(RMPP组)患儿。MSMP组:男33例,女25例,平均年龄(6.33±2.65)岁。MSMP组:男28例,女22例,平均年龄(6.52±2.60)岁。另外在我院儿保科纳入年龄(6.24±2.61)岁、性别相匹配(男23例,女27例)的50例健康体检儿童作为对照组。MPP患儿纳入标准:①年龄2~12岁;
②所有受试儿童的监护人均签署书面知情同意书;
③MPP是根据影像学诊断并经血清学检查证实的,采用被动颗粒凝集法检测,双份血清MP-IgM抗体滴度呈4倍或4倍以上增高或单份血清滴度≥1∶160则判定为阳性[7];
所有患儿在胸部摄片上都有肺炎性病变[8];
④经咽拭洗液或痰液培养支原体,结果呈阳性;
⑤所有被诊断为MPP的患儿都使用大环内酯和广谱抗菌素(阿莫西林/克拉维酸或头孢呋辛)进行治疗,RMPP被定义为在适当的大环内酯抗生素治疗后仍有长期发热并伴有放射学表现恶化[8];
⑥所有患儿血液样本采集时都处于急性期,出现发热、顽固性咳嗽、肺部听诊异常等典型症状。对照组的纳入标准为过去3个月内无免疫系统疾病、慢性传染病、呼吸道感染、其他急慢性疾病、过敏及与免疫力密切相关的疾病。排除病毒性或细菌性呼吸道病原体感染,支气管哮喘、支气管异物、肺结核、肺部真菌病、肺寄生虫病、间质性肺疾病、先天性肺疾病、肺部肿瘤、代谢性疾病、过敏性疾病或先天性免疫缺陷等基础疾病者;
入组前1个月有疫苗接种史者。
1.2 流式细胞术检测外周血Th17、Treg细胞百分比 入院后取每例患儿次日清晨的外周静脉血3 mL,对照组儿童采集体检当日清晨静脉血样本3 mL。将血液样品进行肝素抗凝后,用PBS稀释,离心洗涤,制备了外周血单核细胞(PBMCs)悬浮液。调整细胞浓度至2×106/mL。取一份PBMCs样本,用离子霉素(1 mg/mL)、佛波醇酯(50 mg/mL)和布雷非德菌素A(1 mg/mL)处理,检测Th17细胞。试管被放置在5% CO2培养箱中4 h,加入20 mL APC标记的抗CD3单克隆抗体和20 mL FITC标记的抗CD8抗体。混匀后,避光4 ℃孵育30 min,加入破膜缓冲液避光孵育60 min,加入10 mL PE标记的抗IL-17A抗体,避光孵育30 min,保存在4 ℃直至分析。取另一份PBMCs样本,加入20 mL PerCP-Cy 5.5标记的抗CD3单克隆抗体、20 mL FITC标记的抗CD4抗体、20 mL PE标记的抗CD25抗体和20mL Alexa Fluor 647标记的抗CD127抗体,避光4 ℃孵育30 min,保存在4 ℃直至分析。采用FACSCalibur流式细胞仪和Cellquest软件进行数据分析。
1.3 酶联免疫吸附法测定血清细胞因子水平 血液样品静置凝固后,以3 000 r/min离心5 min,收集上清液,储存在-70 ℃,以便随后进行分析。用人ELISA试剂盒检测血清IL-17和转化生长因子β1(TGF-β1)水平。免疫因子表达水平测定一式三份,以提高准确性。试剂盒购自美国R&D Systems公司。
1.4 实时荧光定量PCR法检测PBMCs miR-29c表达 收集PBMCs,进行细胞裂解,用mirVanaTMmiRNA试剂盒(美国Ambion公司)提取总miRNAs。使用TaqMan MicroRNA反转录试剂盒(美国Applied Biosystems公司)对10 ng的总RNA进行反转录聚合酶链式反应,反应条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃ 5 min。采用TaqMan Universal PCR Master Mix试剂盒(美国Applied Biosystems公司)在Bio-Rad IQ5实时PCR系统中进行热循环反应,以U6为内源对照,反应条件:16℃ 30 min、42 ℃ 30 min、85 ℃ 5 min 和4 ℃ 5 min 进行热循环实验。根据制造商的规定,反应一式三份。热循环条件为:50 ℃ 2 min,95 ℃ 10 min,(95 ℃ 15s+60℃ 1min)×40次。数据分析采用2-ΔΔCt方法。miR-29c引物:(正义链)5′-ACACTCCAGCTGGGTGACCGAT-3′,(反义链)5′-TGGTGTCGTG GAGTCG-3′;
内参U6引物:(正义链)5′-CTCGCTTCGGCAGCACA-3′,(反义链)5′-AACGCTTCACGAATTTGCGT-3′。

2.1 3组基线资料及临床病理特征分析 与对照组相比,MSMP组和RMPP组体温峰值、白细胞(WBC)计数、血小板(PLT)计数、血细胞沉降率、乳酸脱氢酶(LDH)水平升高,同时淋巴细胞(LYM)计数降低(P<0.05);
此外RMPP组患儿血清LDH水平、痰液样本MP-DNA拷贝数和胸腔积液比例高于MSMP组,而LYM计数低于MSMP组,RMPP组患儿以大片状阴影为主,且发热时间和住院时间更长(P<0.05,见表1)。
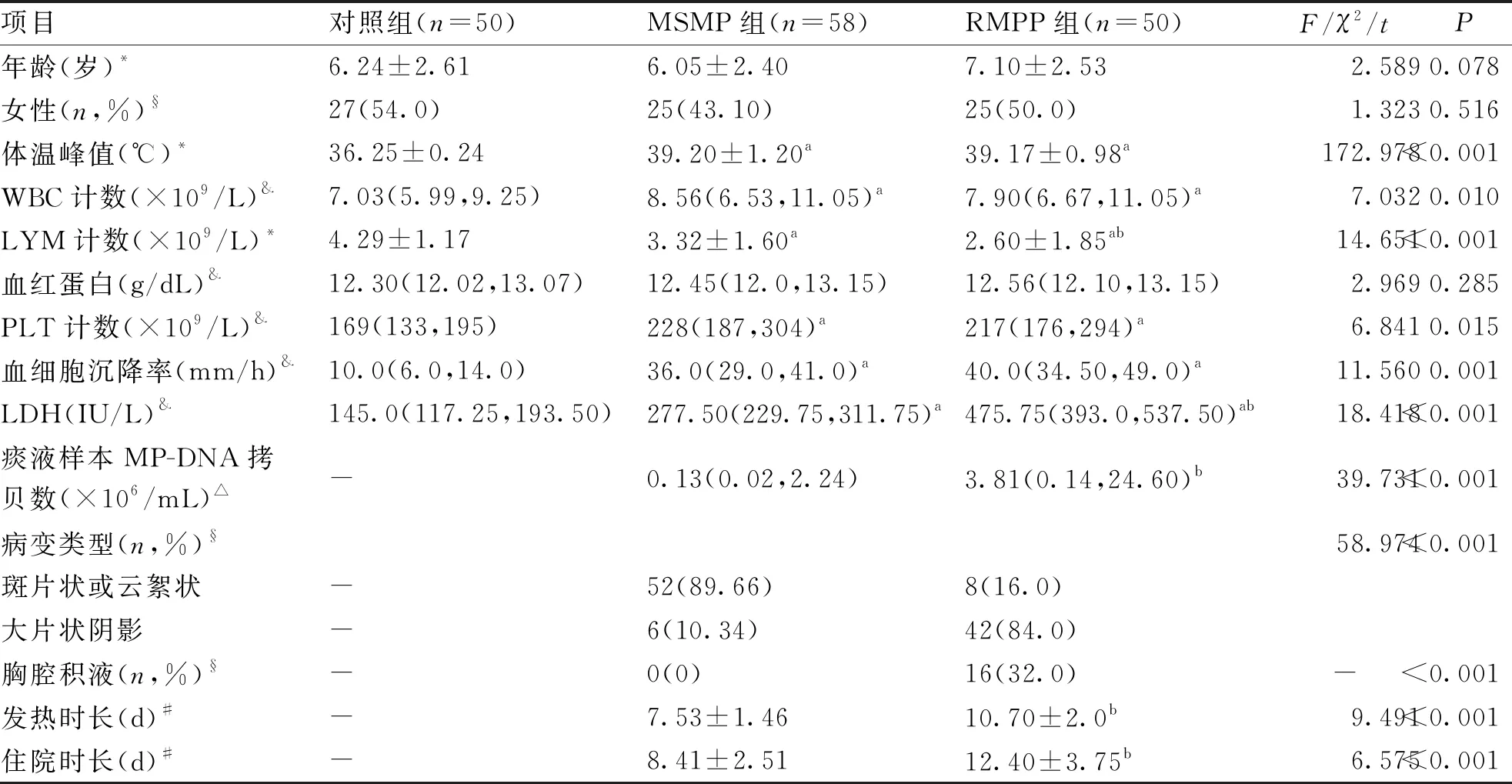
表1 3组基线资料及临床病理特征比较
2.2 MPP患儿PBMCs miR-29c、循环Th17和Treg细胞及其相关细胞因子的变化 与对照组相比,MSMP组和RMPP组CD4+Th17细胞%、CD4+Treg细胞%、Th17/Treg比值以及血清IL-17水平升高,同时PBMCs miR-29c相对表达量降低(P<0.05);
而且RMPP组患儿CD4+Th17细胞百分比、CD4+Treg细胞百分比、Th17/Treg比值以及血清IL-17水平高于MSMP组,PBMCs miR-29c相对表达量低于MSMP组(P<0.05,见表2)。

表2 3组PBMC miR-29c、循环Th17和Treg细胞及其相关细胞因子水平比较
2.3 MPP患儿PBMCs miR-29c与循环Th17和Treg细胞及其相关细胞因子的关系 经Pearson相关系数或Spearson秩相关系数分析,对于所有MPP患儿,无论是MSMP组还是RMPP组,PBMCs miR-29c相对表达量与循环Th17细胞百分比、Th17/Treg比值、血清IL-17水平均呈负相关性(P<0.05,见表3)。

表3 MPP患儿PBMCs miR-29c与循环Th17(%)、Treg细胞(%)及其相关细胞因子的关系
2.4 ROC曲线分析各指标对RMPP的预测效能 经ROC曲线分析,PBMCs miR-29c预测RMPP的AUC为0.932(95%CI:0.888~0.976),优于Th17/Treg比值、血清IL-17、LDH、LYM计数对RMPP的预测效能,而且与LYM计数相比,差异有统计学意义(P<0.05,见图1、表4)。

表4 ROC曲线分析PBMCs miR-29c、Th17/Treg比值、血清IL-17、LDH、LYM计数对RMPP的预测效能

图1 PBMCs miR-29c、Th17/Treg比值、血清IL-17、LDH、LYM计数预测RMPP的ROC曲线
2.5 多因素Logistic回归分析预测RMPP的相关因素 以是否进展为RMPP作为应变量(是=1,否=0),将年龄、PBMCs miR-29c、Th17/Treg比值、血清IL-17、LDH、LYM计数纳入多因素Logistic回归方程,结果显示,LDH、Th17/Treg比值、PBMCs miR-29c对MSMP组和RMPP组之间的鉴别诊断有显著的预测价值,且LDH≥377.80 IU/L、Th17/Treg比值≥0.643患儿进展为RMPP的风险更高,而PBMCs miR-29c≥0.67患儿进展为RMPP风险较低(P<0.05,见表5)。
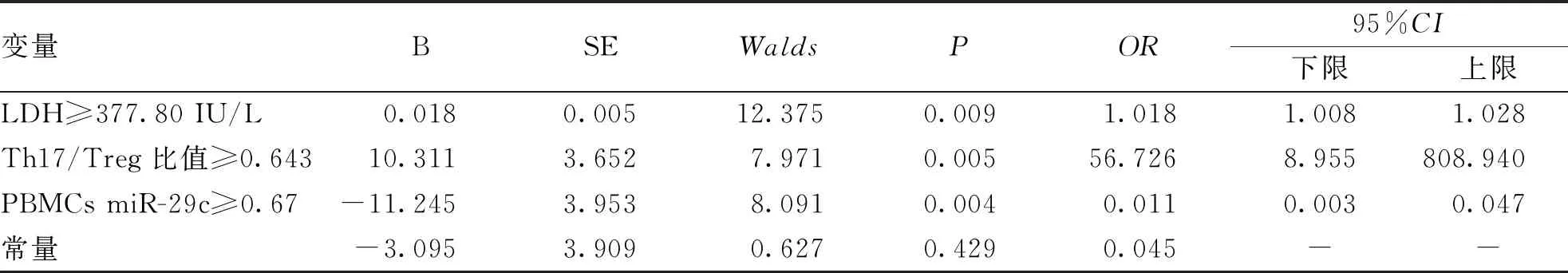
表5 多因素Logistic回归分析预测RMPP的相关因素
MP感染在一些罕见的病例中可以发展成一种危及生命的疾病,如RMPP、急性呼吸窘迫综合征、坏死性肺炎和暴发性肺炎[9]。有报道证实,虽然MPP的发病机制复杂多样,但其疾病的严重程度似乎取决于宿主对感染的免疫反应,包括对MP的变态反应、MP毒力、宿主防御,以及趋向Th1或Th2优势的极化[5-6,10]。
近年来,越来越多的研究证实Th17/Treg失衡在炎症或自身免疫性疾病中发挥着重要作用。作为重要的阳性效应T细胞亚群,Th17以大量释放促炎因子IL-17为主要特征[11]。在肺组织损伤中,IL-17可以促进支气管成纤维细胞、上皮细胞和平滑肌细胞活化。这些细胞依次被诱导表达多种促炎性细胞因子,以促进气道中性粒细胞的局部浸润和增殖,加重气道和肺部的炎症反应[12]。而外周血中Th17细胞比例也可以作为反映慢性阻塞性肺病[13]、哮喘[14]、成人社区获得性肺炎[15]等患者炎症反应的有效指标。另一方面,有报道称诱导性调节性T细胞(iTreg)有助于抑制超免疫反应。D’alessio等[16]首次发现Treg细胞在小鼠和急性肺损伤(ALI)患者的BALF中大量积累,并通过诱导TGF-β1和中性粒细胞凋亡促进ALI好转。而Th17/Treg平衡独立于Th1/Th2平衡,被认为在免疫中发挥着关键作用[17]。同样在本研究中,发现MPP患儿与对照组相比,Th17细胞(%)及其标志性细胞因子IL-17的浓度显著增加。这些结果表明,循环Th17细胞在反映肺损伤严重程度方面具有潜在的作用。除了Th17细胞(%)增加外,Treg细胞分化也增强了,而且RMPP患儿Th17/Treg比值高于MSMP患儿和对照组,说明RMPP患儿机体Th17/Treg更趋向于促炎症反应,因此Th17/Treg失衡可能是影响RMPP病理或疾病结局的主要原因,但是其具体机制尚不清楚。
多项研究表明MP可以刺激肺泡巨噬细胞产生IL-23,IL-23可以诱导活化的CD4+T细胞产生IL-17。而这种激活和分化则需要双重信号刺激,共刺激分子B7家族分子在其中发挥着关键作用[18-19]。例如B7-H3在T细胞受体(TCR)与抗原/主要组织相容性复合物(MHC)相互作用后,起到放大或中和T细胞初始激活信号的作用,从而影响T细胞分化。最近,Luo等[20]证实B7-H3对Th1/Th17具有调节作用,可以增强γ干扰素和IL-17的产生[20-21]。而B7-H3基因表达受多种因素控制,包括miRNAs。Li等[5]通过荧光素酶报告实验证实B7-H3是miR-29c的直接靶点,并且通过体外研究证实miR-29c/B7-H3/Th17轴的调节作用。在本研究中,我们也证实无论是MSMP组患儿还是RMPP患儿,在急性期时PBMCs miR-29c表达与循环Th17细胞%、Th17/Treg比值、血清IL-17水平均呈负相关性,说明在MPP疾病过程中,miR-29c低表达可能会诱导Th17细胞分化导致Th17/Treg失衡,进而加重疾病进展。但是在多因素分析中,Th17/Treg失衡和PBMCs miR-29c都是影响RMPP的独立预测因子,说明在疾病加重过程中还有其他分子机制影响Th17/Treg失衡。
总之,本研究证实在MPP患儿中PBMCs miR-29c低表达可诱导Th17细胞分化,进而促进Th17/Treg失衡,这可能是导致RMPP进展的重要机制之一。但是本研究也存在一些局限性。首先,这是一个单中心的研究,样本量不大,因此限制了普遍性。其次,研究了外周血Th17和Treg细胞的变化。理想的情况下,应该从发生炎症事件的肺泡腔或肺组织中取样。然而,通过支气管肺泡灌洗和(或)活组织检查获得的样本有限,尤其是儿童患者。但是无论如何本组数据证实,在MPP患儿中存在循环Th17和Treg 细胞的改变,并且与疾病风险增加有关,这表明结果具有较高的可靠性。
猜你喜欢比值计数细胞因子古人计数数学小灵通(1-2年级)(2021年11期)2021-12-02抗GD2抗体联合细胞因子在高危NB治疗中的研究进展现代临床医学(2021年4期)2021-07-31递归计数的六种方式中等数学(2020年8期)2020-11-26古代的计数方法小学生学习指导(低年级)(2020年4期)2020-06-02这样“计数”不恼人数学小灵通·3-4年级(2017年11期)2017-11-29比值遥感蚀变信息提取及阈值确定(插图)河北遥感(2017年2期)2017-08-07急性心肌梗死病人细胞因子表达及临床意义中西医结合心脑血管病杂志(2016年20期)2016-03-01不同应变率比值计算方法在甲状腺恶性肿瘤诊断中的应用中国医学影像学杂志(2015年9期)2015-12-15细胞因子在慢性肾缺血与肾小管-间质纤维化过程中的作用医学研究杂志(2015年12期)2015-06-10双电机比值联动控制系统电子设计工程(2014年18期)2014-02-27